
등압과정(Isobaric process), 등적과정(Isochoric process)의 정의
일정압력에서 일어나는 공정을 등압과정(Isobaric process)이라고 한다.
일정부피에서 일어나는 공정을 등적과정(Isochoric process)이라고 한다.
열용량
열용량은 물질을 1ºC 높이는 데 필요한 열량이다.
이것을 미분형태로 나타내면

이 된다. C의 단위는 kcal/ºC 이다.
일
중학교 때 배우는 일반적인 일을 구하는 식은

이다. 하지만 열역학에서 쓰는 일은 이런 역학적인 일 표현과는 다른 형태를 주로 사용한다.
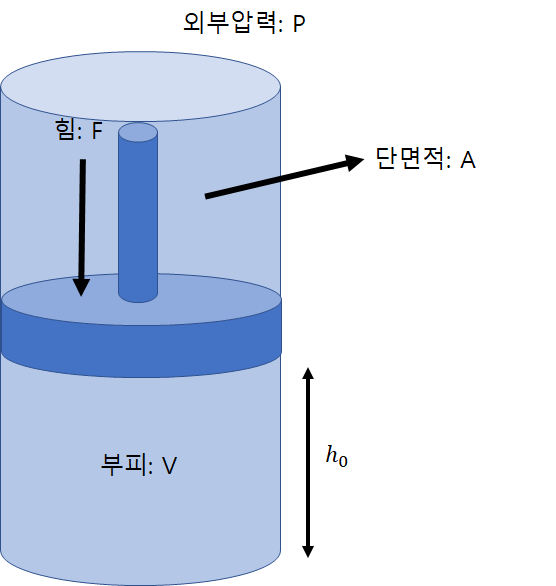
이렇게 생긴 실린더를 생각해보자.
실린더 내부의 부피를 변화시키기 위해서는 얼만큼의 일이 필요할까?
실린더 안쪽으로 주어지는 힘 F는 실린더의 단면적과 외부압력의 곱이다.
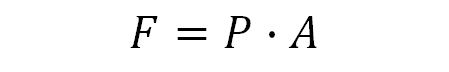
압력이 단위면적당 주어지는 힘이기 때문이다.
이 실린더의 부피가 피스톤을 올림으로서 변화한다면
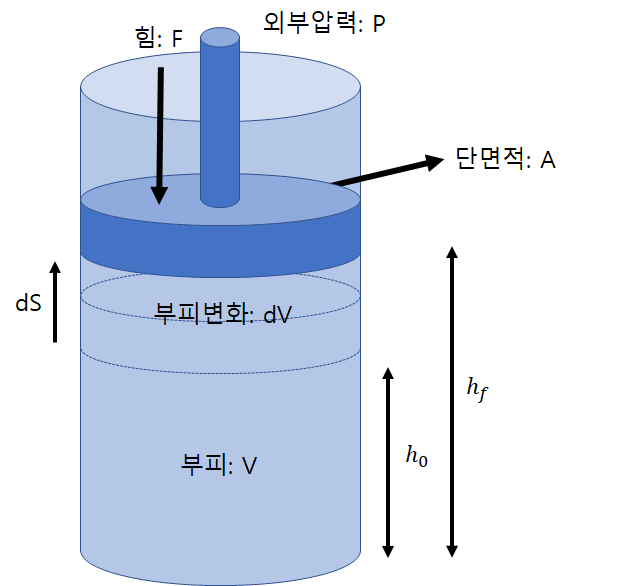
그 부피 변화를 dV 그리고 피스톤을 올린 거리를 dS라고 나타낼 수 있다. 위의 그림을 참고하자.
실린더에서 안쪽으로 작용하는 힘은 일정하다 그렇기 때문에 F는 상수로 볼 수 있고 일은 다음과 같이 나타낼 수 있다.
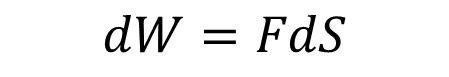
dW라고 표현하는 이유는 dS가 미소한 변화이기 때문에 dW도 미소하다는 의미이다.
왜 미소한 변화를 사용하는지는 다음 글에서 설명할 가역공정에서 설명하겠다.
힘이 압력과 단면적의 곱이기 때문에

로 나타낼 수 있다. 부피의 변화는 피스톤의 단면적과 피스톤이 움직인 거리의 곱이기 때문에

로 나타낼 수 있고 우리가 원하는 식

이 나오게 된다. 열역학에서는 이 식을 주로 사용하게 된다. 열역학 과정에서의 W를 구하려면 이 식을 적분하여

로 구하게 된다.
등적과정에서의 열용량
열역학 1법칙에서 유도된 식

를 미분 형태로 바꿔주면

로 나타낼 수 있다.
저 식이 어떻게 나왔나?를 알고싶다면
2020/12/15 - [화학공학] - (열역학 개념 1) 열역학 법칙, 열역학 제 1법칙 설명
(열역학 개념 1) 열역학 법칙, 열역학 제 1법칙 설명
공대에서 열역학을 배우면 가장 먼저 배우는 것이 열역학 법칙이다. 열역학 법칙은 0,1,2,3 법칙 이렇게 총 4가지가 있다. 이 4가지 법칙은 '열역학적 과정', '열역학적 계를 설명하는 온도, 열량,
veritable.tistory.com
이 글을 참고하기 바란다.
어쨌든 위의 식에서

를 이용하면

가 된다. 등적과정은 부피는 변하지 않기 때문에 dV = 0 이고 그렇다면
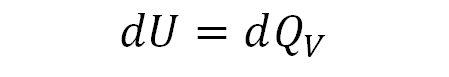
가 된다. 열량과 열용량 관계에 따라

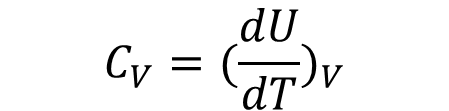
가 된다. 아래첨자로 적힌 V는 부피가 일정하다는 뜻이다. 압력이 일정하면 아래첨자에 압력을 뜻하는 P를 적는다.
등압과정에서의 열용량
내부에너지의 변화량을 나타내는 식

에서

여기서 왼쪽의 식은 엔탈피를 미분한 것과 같다.

엔탈피의 정의에서 양변을 미분꼴로 나타내주면

로 나타낼 수 있다. 여기서 dP = 0 (등압조건)이기 때문에

가 된다. 즉 등압조건에서는

가 되고 이 식은 열용량의 정의에 따라


가 된다.
이상기체에서의 정적열용량과 정압열용량의 관계
대기업 전공 면접질문에 가끔 정적열용량과 정압열용량의 관계를 묻는 질문이 나온다. 별로 어려운 부분이 아니니 준비를 조금만 하고 머릿속에 넣어놓는다면 술술 말하고 직무 잘보고 나올 수 있다.
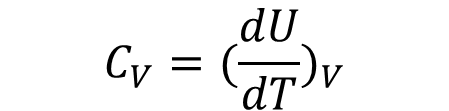

에서

가 된다. 여기서 이상기체는 PV = RT 이기 때문에

이 된다.
즉 Cp 식에서 앞항은 Cv 이고 뒷항은 R이 되므로
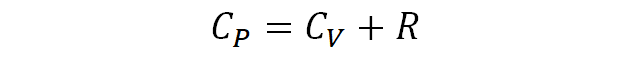
이 된다.
'화학공학' 카테고리의 다른 글
| (열역학 개념 1) 열역학 법칙, 열역학 제 1법칙 설명 (0) | 2020.12.15 |
|---|
